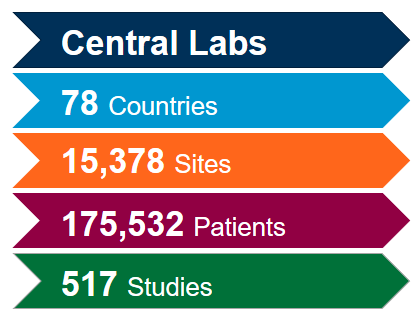
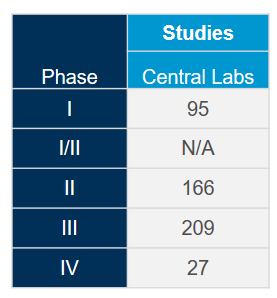
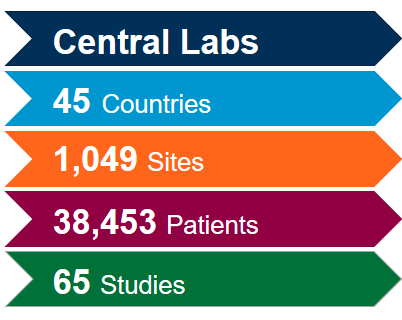
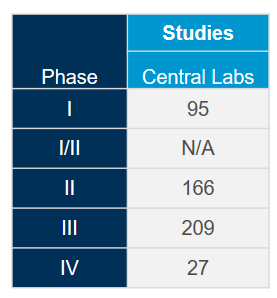
Tenemos las soluciones que necesita para su ensayo o trabajo con biomarcadores para COVID-19
Aproveche al máximo nuestra red de laboratorios centrales integrados a nivel mundial con la ayuda de nuestros expertos en ciencia y operaciones. Puesto que tenemos una amplia experiencia adquirida en más de 4.400 ensayos clínicos llevados a cabo durante los últimos cinco años en diversas áreas terapéuticas, estamos en posición de optimizar sus estudios y mitigar posibles problemas para cumplir con el ritmo acelerado asociado a los estudios sobre coronavirus (COVID-19).